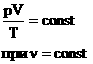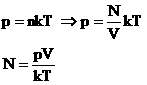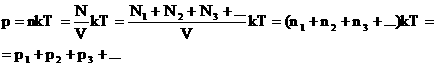- Главная
- Для учителя
- Архив заданий олимпиад по физике за 2009-2015 годы
- Владимир Анатольевич Зверев предлагает
- Несколько ссылок на работы Анатолия Шперха
- Общие вопросы методики обучения физике
- Статьи Александра Борисовича Рыбакова
- Важнейший общефизический принцип остается непонятым
- Рыбаков А. Б. Почитаем «Физику» вместе
- Рыбаков А.Б. Несколько замечаний о «Физике (ПС)», №10, 2015
- Рыбаков А.Б. О №12 «Физики (ПС)» и динамике автомобиля, или Спасут ли школу вузовские преподаватели?
- А.Б.Рыбаков Банджи-джампинг, сохранение импульса и уравнение Мещерского
- Рыбаков А.Б. О вращении Земли и всяком таком, или Удивительная физика в журнале «Физика (ПС)», №2/2015
- Экзамены
- Конспекты
- История физики
- Библиотека
- Медиатека
- О нас
Уравнение состояния идеального газа. Газовые законы.
|
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). |
|
|
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние. В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул. |
|
|
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m. Мы знаем, что |
|
|
Произведение постоянных величин есть величина постоянная, следовательно: |
|
|
Таким образом, имеем:
|
|
|
Другие формы записи уравнения состояния идеального газа. |
|
|
1.Уравнение для 1 моля вещества. Если n=1 моль, то, обозначив объем одного моля Vм, получим: Для нормальных условий получим: |
|
|
2. Запись уравнения через плотность: |
|
|
3. Уравнение Клапейрона. Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества n=const. Тогда: |
|
|
Эта запись означает, что для данной массы данного газа справедливо равенство: |
|
|
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: |
|
|
Газовые законы. |
|
|
1. Закон Авогадро. В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов). Условие: V1=V2=…=Vn; p1=p2=…=pn; T1=T2=…=Tn |
|
|
Доказательство:
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково. |
|
|
2. Закон Дальтона. Давление смеси газов равно сумме парциальных (частных) давлений каждого газа. Доказать: p=p1+p2+…+pn Доказательство: |
|
|
3. Закон Паскаля. Давление, производимое на жидкость или газ, передается во все стороны без изменения. |
|

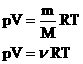 - уравнение состояния (уравнение Менделеева – Клапейрона).
- уравнение состояния (уравнение Менделеева – Клапейрона).