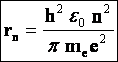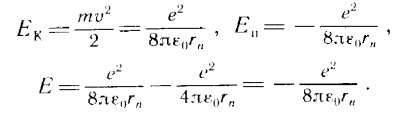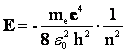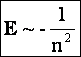- Главная
- Для учителя
- Архив заданий олимпиад по физике за 2009-2015 годы
- Владимир Анатольевич Зверев предлагает
- Несколько ссылок на работы Анатолия Шперха
- Общие вопросы методики обучения физике
- Статьи Александра Борисовича Рыбакова
- Важнейший общефизический принцип остается непонятым
- Рыбаков А. Б. Почитаем «Физику» вместе
- Рыбаков А.Б. Несколько замечаний о «Физике (ПС)», №10, 2015
- Рыбаков А.Б. О №12 «Физики (ПС)» и динамике автомобиля, или Спасут ли школу вузовские преподаватели?
- А.Б.Рыбаков Банджи-джампинг, сохранение импульса и уравнение Мещерского
- Рыбаков А.Б. О вращении Земли и всяком таком, или Удивительная физика в журнале «Физика (ПС)», №2/2015
- Экзамены
- Конспекты
- История физики
- Хронология физики
- Физики. Краткие биографии
- Дополнения к биографиям
- Нобелевские премии по физике
- История методики обучения физике
- Календарь на текущий год
- Физический календарь на 2026 год
- Физический календарь на 2025 год
- Календарь памятных дат в физике на 2023 год
- Юбилейные и памятные даты из истории физики в 2022 году
- Физический календарь на 2015 год
- Физический календарь на 2016 год. ч. 1
- Физический календарь на 2016 год. ч. 2
- Календарь памятных дат в физике на 2019 год
- Физики в Петербурге-Петрограде-Ленинграде
- Библиотека
- Медиатека
- О нас
Спектральные закономерности. Постулаты Бора.
|
Спектральные закономерности |
||
|
В середине 19 в. Г. Кирхгоф обнаружил: свечение газов дает четко выраженные дискретные линии.
Швейцарский физик И. Бальмер эмпирически вывел формулу для спектра водорода (1885): где п — любое целое число >2, т. е. п=3, 4, 5 и т.д. |
||
|
Величина R носит название "постоянная Ридберга" |
||
|
Для инфракрасной области спектра аналогичную формулу вывел Ф.Пашен:
где п — любое целое число >3, т. е. п = 4, 5 и т.д. |
||
|
Значения длин волн спектральных линий, вычисленных по этим формулам, совпадали с исключительной точностью со значениями длин волн этих линий, измеренных экспериментально. В конце 19 в. ученые обнаружили фундаментальную закономерность в микромире, которую в то время объяснить не смогли. Только через 30 лет Н. Бор дал физическую интерпретацию этой формулы. Он предположил, что два члена в формуле Бальмера представляют собой полные энергии разрешенных орбит электрона в атоме водорода. |
||
|
Преобразовав формулу Бальмера (умножив обе части на h), получим:
|
||
|
Учитывая, что согласно гипотезе Планка энергия
|
||
|
Свои постулаты Н. Бор применил для построения теории атома водорода. |
||
|
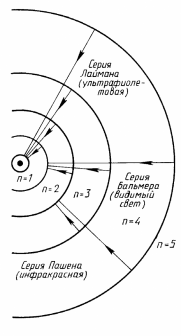
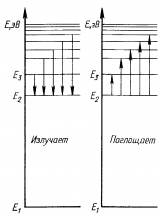
1. Атомная система может находиться только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия Еn . В стационарном состоянии атом не излучает. |
||
|
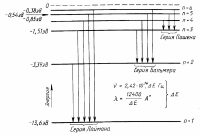
2. При переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En излучается квант энергии: |
||
|
3. К этим постулатам следует добавить правило квантования орбит: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса где rn — радиус n-ой орбиты; vn — скорость электрона на этой орбите; me — масса электрона, п — целое число — номер орбиты или главное квантовое число. |
|
|
|
Модель атома водорода по Бору |
|
|
|
|
||
|
|
||
|
|
||
|
Если п=1, а r1 =0,5-10-10 м, то r2=r1.n2=4r1, r3=9r1 и т.д.
Т.о. |
|
|
|
|
||
|
Подставляя выражение для радиуса стационарной орбиты, получим: Знак "-" говорит о том, что между электроном и ядром действуют силы притяжения. |
|
|
|
|
||
|
Трудности теории Бора Правило квантования Бора применимо не всегда, представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось условным. Теория Бора неприменима для многоэлектронных атомов и не объясняет ряд спектральных закономерностей. |
||
|
В 1917 г. А. Эйнштейн предсказал возможность перехода атома с высшего энергетического состояния в низшее под влиянием внешнего воздействия. Такое излучение называется вынужденным излучением и лежит в основе работы лазеров. |
||

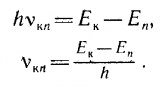
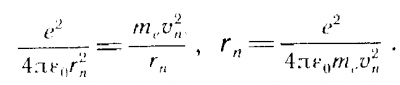
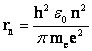 ,
,